Tác giả: ThS.BS Hồ Thị Dạ Thảo, PGS.TS Trần Xuân Chương
Chi hội Truyền Nhiễm – HIV/AIDS
I. Dịch tễ học lao kháng thuốc
Trên thế giới
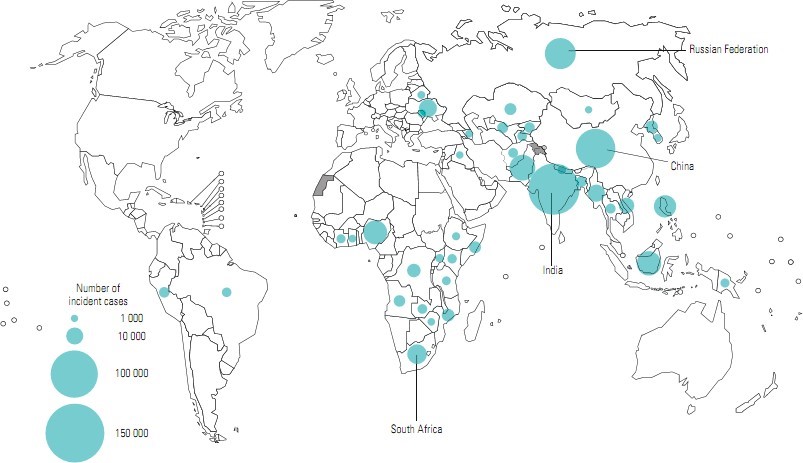
Lao kháng thuốc vẫn còn là vấn đề sức khỏe quan trọng tại nhiều quốc gia. Theo báo cáo của Tổ chức Y tế Thế giới (WHO) 2020, năm 2019 trên toàn cầu ghi nhận gần 465.000 (400.000 – 535.000) trường hợp mắc bệnh lao kháng rifampicin (RR- TB). Trong số đó, khoảng 78% các trường hợp là lao đa kháng thuốc (MDR-TB). Ba quốc gia có gánh nặng lao kháng thuốc cao nhất là Ấn Độ (27%), Trung Quốc (14%) và Liên Bang Nga (8%), chiếm gần 50% tổng số các trường hợp lao kháng thuốc trên toàn cầu. Tỷ lệ bệnh lao kháng rifampicin và đa kháng thuốc (RR/MDR-TB) trên thế giới trong năm 2019 là 3,3% trong tổng số ca mắc lao mới và 17,7% trong các trường hợp được điều trị lao trước đó. Năm 2019 thế giới ghi nhận khoảng 182.000 trường hợp tử vong do RR/MDR-TB [8].
Hình 1.1. Các quốc gia có số ca mắc bệnh lao kháng rifampicin và đa kháng thuốc trên 1000 [8]
Tại Việt Nam
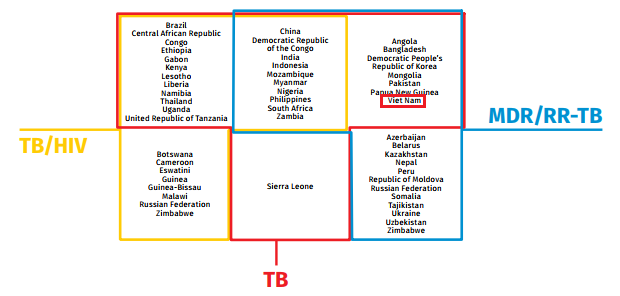
Việt Nam nằm trong top 17 quốc gia có gánh nặng về bệnh lao kháng rifampicin/đa kháng thuốc. Theo báo cáo của WHO 2020, số liệu vào năm 2019 ghi nhận số ca mắc RR/MDR-TB là 8.400 trường hợp (5.300-12.000). Trong đó, tỷ lệ RR/MDR-TB trong tổng số ca mắc lao mới là 3,6% và trong tổng số ca có tiền sử điều trị lao là 17% [8]. So sánh số liệu thống kê trong 5 năm trở lại đây của WHO, tỷ lệ mắc lao đa kháng thuốc tại Việt Nam có xu hướng giảm rất chậm, điều này đặt ra nhiều thách thức trong công tác dự phòng, phát hiện cũng như chẩn đoán sớm và điều trị sớm các trường hợp lao kháng thuốc. Hiện nay đã có những cải tiến trong việc triển khai các xét nghiệm lao kháng thuốc nói chung và kháng rifampicine nói riêng từ năm 2019-2020. Việt Nam là một trong 30 quốc gia có gánh nặng về lao kháng thuốc đã đạt đến 80% số xét nghiệm phát hiện vi khuẩn lao kháng rifampicin [9].
Hình 1.2. Danh sách các quốc gia có gánh nặng về bệnh lao, bệnh lao và HIV và MDR/RR-TB được WHO công bố trong giai đoạn 2021-2025 [9].
II. Phân loại lao kháng thuốc
– Kháng đơn thuốc: Chỉ kháng với duy nhất một thuốc chống lao hàng một khác rifampicin
– Kháng nhiều thuốc: Kháng với từ hai thuốc chống lao hàng một trở lên mà không kháng với rifampicin
– Lao kháng rifampicin: Kháng với rifampicin, có hoặc không kháng thêm với các thuốc lao khác kèm theo (có thể là kháng đơn thuốc, kháng nhiều thuốc, đa kháng 8 thuốc hoặc siêu kháng thuốc). Tuy nhiên ở Việt Nam hiện nay, các chủng đã kháng với rifampicin thì có tới trên 90% có kèm theo kháng isoniazid. Vì vậy khi phát hiện kháng rifampicin, người bệnh được coi như đa kháng thuốc và thu nhận điều trị phác đồ đa kháng.
– Đa kháng thuốc (MDR-TB): Kháng đồng thời với ít nhất hai thuốc chống lao là
isoniazid và rifampicin.
– Tiền siêu kháng: Lao đa kháng có kháng thêm với bất cứ thuốc nào thuộc nhóm fluoroquinolone hoặc với ít nhất một trong ba thuốc tiêm hàng hai capreomycin, kanamycin, amikacin.
– Siêu kháng thuốc (XDR-TB): Lao đa kháng có kháng thêm với bất cứ thuốc nào thuộc nhóm fluoroquinolone và bất cứ thuốc nào trong ba thuốc tiêm hàng hai (capreomycin, kanamycin, amikacin) [2].
III. Các nhóm đối tượng cần được tầm soát lao kháng thuốc
– Người bệnh lao thất bại phác đồ điều trị lao không kháng rifampicin (bao gồm lao nhạy cảm, kháng đơn và nhiều thuốc)
– Người nghi lao mới hoặc người bệnh lao mới có tiếp xúc với người bệnh lao đa kháng.
– Người bệnh lao không âm hóa đờm sau 2 hoặc 3 tháng điều trị phác đồ lao không kháng rifampicin
– Người bệnh lao tái phát phác đồ lao không kháng và kháng rifampicin
– Người bệnh lao điều trị lại sau bỏ trị
– Người bệnh lao mới có HIV (+)
– Các trường hợp khác: Bao gồm người nghi lao hoặc người bệnh lao có tiền sử dùng thuốc lao trên 1 tháng (bao gồm cả người nghi lao tái phát, người nghi lao sau bỏ trị, người nghi lao hoặc người bệnh lao có tiền sử điều trị lao ở y tế tư nhưng không rõ kết quả điều trị)
– Người bệnh lao phổi mới: Nên được sàng lọc trong số AFB (+) hoặc mở rộng tới AFB (-) tùy chủ trương và nguồn lực của CTCLQG tại mỗi giai đoạn [2].
IV. Các xét nghiệm chẩn đoán lao kháng thuốc
Hiện nay để chẩn đoán lao kháng thuốc cần căn cứ vào kết quả kháng sinh đồ hoặc các xét nghiệm chẩn đoán nhanh được WHO chứng thực như: Hain test, Xpert MTB/RIF.
- Hain test (xét nghiệm LPA)
Năm 2008, Tổ chức Y tế Thế giới (WHO) đã thông qua việc sử dụng xét nghiệm LPA hàng 1, GenoType MTBDRplus (gọi tắt là GenoType MTBDRplus V1), để phát hiện nhanh vi khuẩn lao kháng đồng thời rifampicin (Rif) và isoniazid (H). Sau đó, các phiên bản mới hơn của công nghệ LPA đã được phát triển từ năm 2011, bao gồm GenoType MTBDRplus phiên bản 2 (gọi tắt là GenoType MTBDRplus V2) và Nipro NTM + MDRTB detection kit 2 (được gọi là Nipro, Tokyo, Nhật Bản) giúp phát hiện các đột biến liên quan đến kháng fluoroquinolone, thuốc tiêm hàng hai và chính thức được sử dụng từ 2015.
Nguyên lý kỹ thuật: Thông qua liên kết giữa các sản phẩm khuếch đại DNA với các mẫu dò đích tại các vị trí đột biến phổ biến quy định tính kháng thuốc hàng 1 và hàng 2 và các mẫu dò đích tương ứng với trình tự DNA hoang dại.
GenoType MTBDRplus phiên bản 1 sẽ nhắm vào các đột biến cụ thể trong vùng xác định kháng Rif (RRDR) của gen rpoB (từ codon 505 đến 533) để phát hiện kháng Rif và đột biến trong vùng promoter inhA (từ -16 đến -8 nucleotide ngược dòng) và vùng katG (codon 315) để xác định kháng H.
GenoType MTBDRplus phiên bản 2 bao gồm vùng xác định kháng quinolone (QRDR) của gyrA (từ codon 85 đến 96) và của gyrB (từ codon 536 đến 541) là các gen quy định tính kháng Fluoroquinolone và gen rrs (vị trí nu 1401, 1402 và 1484) và vùng promoter eis (từ -37 đến -2 nu ngược dòng) để phát hiện kháng thuốc tiêm hàng 2.
LPA hàng 1 cho thấy độ nhạy và độ đặc hiệu tính kháng rifampicin lần lượt là 96,7% và 98,8% và cho tính kháng isoniazid với độ nhạy và độ đặc hiệu lần lượt là 90,2% và 99,2%. LPA hàng 2 (GenoType MTBDRsl V1) cho thấy độ nhạy và độ đặc hiệu kháng fluoroquinolone bằng cách xét nghiệm mẫu trực tiếp lần lượt 86,2% và 98,6%, và độ nhạy và độ đặc hiệu kháng thuốc thuốc tiêm hàng hai là 87,0 % và 99,5% [5].
- Xpert MTB/RIF
Xpert MTB/RIF là một trong hai xét nghiệm của NAA test (Nucleic acid amplification) được phát triển để phát hiện M. tuberculosis complex trực tiếp trên mẫu đàm và tình trạng kháng rifampicin của bệnh nhân trong vòng 2 giờ. Xét nghệm này sử dụng 3 đoạn mồi đặc hiệu và 5 đầu dò (probes) phân tử riêng biệt để phát hiện những đột biến trên bộ vùng lõi 81 bp của đoạn gene rpoB – vùng quy định tính kháng thuốc rifampicin của vi khuẩn lao – [4],[6], [7]. Đây là xét nghiệm mang tính đột phá tích hợp của 3 công nghệ (tách gen, khuếch đại gen và nhận biết gen) đã được phát triển trong khuôn khổ hợp tác của tổ chức FIND (Foundation for Innovative New Diagnostics), Cepheid Inc và Trường đại học Y – Nha khoa New Jersey, Mỹ [1].
Xpert MTB/RIF cho phép xác định vi khuẩn lao với độ nhạy rất cao, lên tới 90-99% ở những bệnh phẩm đàm có AFB dương và 66-74% đối với các mẫu bệnh phẩm đàm có AFB âm tính [1]. Mặc dù độ nhạy của xét nghiệm này giảm với mẫu đàm có AFB âm tính, xét nghiệm này vẫn được khuyến cáo cho những BN nghi ngờ mắc bệnh lao nhờ hiệu quả vượt trội so với xét nghiệm soi kính tìm AFB thông thường [4].
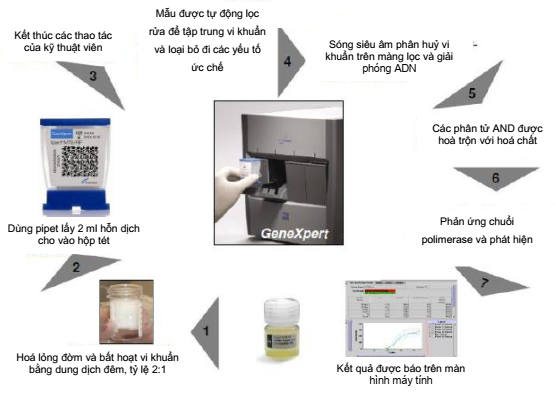
Xpert MTB/RIF được thực hiện trên máy GeneXpert là một hệ thống hoàn toàn tự động, dễ sử dụng và một hệ thống khuếch đại gene hoàn toàn khép kín giúp làm giảm khả năng lây nhiễm chéo giữa các mẫu bệnh phẩm. Xét nghiệm này được thực hiện đơn giản đối với các kỹ thuật viên và không cần các trang thiết bị an toàn sinh học hiện đại. Vì những lý do trên, vào tháng 12 năm 2010, WHO lần đầu tiên khuyến nghị sử dụng xét nghiệm Xpert MTB / RIF cho những BN nghi ngờ lao phổi ở các nước đang phát triển [4].
Hình 1.3. Quy trình thực hiện xét nghiệm Xpert MTB/RIF [3]
V. Hậu quả của lao kháng thuốc
Lao kháng thuốc ảnh hưởng đến hiệu quả điều trị, dự phòng bệnh lao trên toàn cầu và là mối quan tâm lớn về sức khỏe cộng đồng ở nhiều quốc gia.
Điều trị lao kháng thuốc rất khó, phức tạp, thời gian kéo dài mà tiên lượng điều trị thường xấu hơn nhiều so với mắc lao không kháng thuốc. Bình thường người bệnh lao không kháng thuốc chỉ cần điều trị phác đồ trong 6 tháng với thuốc kháng lao hàng 1 có tỷ lệ điều trị thành công lên tới 91% thì lao kháng thuốc, với phác đồ kéo dài từ 9-20 tháng, tỷ lệ thành công chỉ 57%. Bên cạnh đó, với những thuốc khá độc tính, người bệnh phải chịu hàng loạt tác dụng phụ của thuốc, tổn hại trầm trọng đến sức khỏe. Nhiều trường hợp không thể tiếp tục điều trị do các biến cố bất lợi từ thuốc gây lên.
Về chi phí, điều trị lao kháng thuốc cực kỳ tốn kém, cao gấp nhiều lần so với điều trị lao thông thường. Theo báo cáo của Tổ chức Y tế Thế giới, chi phí chữa trị trung bình cho một trường hợp mắc lao đa kháng thuốc vào năm 2019 là 5659 đô la Mỹ, cao hơn gấp 6 lần so với chi phí chữa trị ở bệnh nhân lao thông thường là 860 đô la Mỹ.
Đối với cộng đồng, sẽ rất nguy hiểm cho những người xung quanh nếu bị lây nhiễm vi khuẩn lao kháng thuốc từ người bệnh, nhất là từ người bệnh lao đa kháng thuốc, siêu kháng thuốc.
Vì vậy, việc tầm soát diện rộng, chẩn đoán sớm, điều trị sớm các trường hợp lao kháng và không kháng thuốc đóng vai trò quan trọng trong công tác dự phòng bệnh lao nói chung và lao kháng thuốc nói riêng nhằm giảm tần suất xuất hiện các đột biến kháng thuốc mới trong cộng đồng.
Tài liệu tham khảo
- Bộ Y tế (2011), Quyết định về việc ban hành Hướng dẫn Quy trình triển khai kỹ thuật Genexpert, Hà Nội.
- Bộ Y tế (2020), Hướng dẫn chẩn đoán, điều trị và dự phòng bệnh lao, Hà Nội.
- Nguyễn Kim Cương (2017), Đặc điểm lâm sàng, cận lâm sàng và giá trị kỹ thuật GeneXpert MTB/RIF trong chẩn đoán lao phổi AFB (-) ở người nhiễm HIV, Luận án Tiến Sĩ Y học, Trường Đại học Y Hà Nội, Hà Nội.
- Caulfield A. J., Wengenack N. L. (2016), “Diagnosis of active tuberculosis disease: From microscopy to molecular techniques“, J Clin Tuberc Other Mycobact Dis. 4, pp. 33-43.
- Global laboratory initiative (2019), Xét nghiệm LPA phát hiện tính kháng thuốc của vi khuẩn lao, Cơ quan phát triển Quốc tế Hoa Kỳ, Hoa Kỳ.
- Lawn S. D., Nicol M. P. (2011), “Xpert® MTB/RIF assay: development, evaluation and implementation of a new rapid molecular diagnostic for tuberculosis and rifampicin resistance“, Future Microbiol. 6(9), pp. 1067-1082.
- WHO (2014), Xpert MTB/RIF implementation manual, Switzerland.
- WHO (2020), Global tuberculosis report 2020, Switzerland.
- WHO (2021), Global tuberculosis report 2021, Switzerland.